Construção de membrana amarrada
As membranas amarradas são bicamadas de fosfolípidos suportadas planar acima de um eletrodo de ouro por um conjunto de cadeias de polietilenoglicol (PEG) hidrófilas ligadas covalentemente à superfície do ouro por âncoras de dissulfureto orgânico . Um grupo de alcano- fitoilo lipofílico está ligado ao topo da cadeia de PEG que atua como um andaime em torno do qual os lipídios da membrana se agrupam espontaneamente, formando eventualmente uma membrana contínua.
Juntos, a âncora de dissulfureto, a cadeia de PEG e o grupo de fitoilo são referidos como um cordão molecular, porque conecta a membrana à superfície do ouro. Na prática, os tethers são separados uns dos outros sobre o substrato de ouro por moléculas similares, chamadas espaçadores, que não possuem o grupo lipofílico de fitoilo . Estes espaçadores sentam-se sob a membrana e não têm contato direto com ele. As aparas e os espaçadores cobrem completamente a superfície do ouro, mas não estão bem embalados, já que são separados pela maioria dos grupos âncora de organodissulfito.
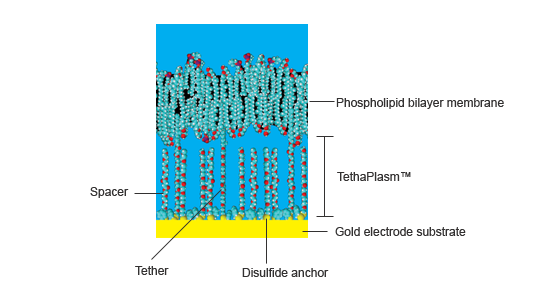
Figura 1. Componentes de um sistema de membrana amarrada
A distância média entre as amarras e os espaçadores pode conter cerca de 9 moléculas de água, enquanto a altura da membrana acima da superfície do ouro é de cerca de 2 a 4 nm (dependendo do ângulo que o espaçador e as correntes de amarraça fazem com a superfície do ouro) com cerca de 0,5 Nm sendo ocupado pela âncora de organodisulfito.
Assim, o espaço entre a membrana e a superfície do ouro é uma mistura de cadeias de PEG, grupos de âncora dissulfureto, moléculas de água, vários catiões e aniões e pequenas moléculas solúveis em água. É coletivamente conhecido como o tethaPlasm ™, e é análogo ao citoplasma de uma célula viva. A aplicação de uma tensão de polarização constante pode ser usada para "carregar" o tethaPlasm com um excesso de catiões ou aniões, antes de experiências TethaPatch ou tehaPod (veja abaixo).
Membranas Tethered são difíceis!
A proporção de aparas para espaços pode ser variada durante o fabrico. O padrão tethaPlate ™ usa uma proporção de 1:10 que normalmente fornece o melhor compromisso entre a estabilidade da membrana e a flexibilidade. Ratios tão pequenos como 1: 100 foram utilizados se for necessária maior flexibilidade, mas menos do que isso não é recomendado, pois a integridade da membrana não é confiável. Por outro lado, podem ser utilizadas proporções de até 100% se for necessária uma estabilidade excepcional.
As membranas amarradas são extremamente robustas com as membranas padrão de 10% com vida útil típica de meses após a preparação (se armazenadas a 4 ° C entre experimentos). Eles também são muito resistentes aos pulsos elétricos e podem suportar potenciais dentro da faixa de -500 a +800 mV, o que é muito maior do que pode ser aplicado em experimentos tradicionais de fixação de tensão de célula total.
 Um tethaPlate ™ compreende seis câmaras cada uma com um eletrodo de ouro (área de superfície 2,1 mm 2 , 3,0 x 0,7 mm) que foi pré-revestida com moléculas de amarração e espaçador. A adição de uma mistura de fosfolípidos adequada é tudo o que é necessário para formar espontaneamente a membrana. Um segundo contra-contador de ouro não revestido fica a 0,15 mm acima da membrana, mas não interage fisicamente com ele.
Um tethaPlate ™ compreende seis câmaras cada uma com um eletrodo de ouro (área de superfície 2,1 mm 2 , 3,0 x 0,7 mm) que foi pré-revestida com moléculas de amarração e espaçador. A adição de uma mistura de fosfolípidos adequada é tudo o que é necessário para formar espontaneamente a membrana. Um segundo contra-contador de ouro não revestido fica a 0,15 mm acima da membrana, mas não interage fisicamente com ele.
O tethaPlate provou ser um invólucro excepcionalmente robusto para as preparações de membrana amarradas que podem ser estáveis para estáveis durante meses quando armazenadas a 4 ° C, enquanto muitas preparações de canais iônicos durarão vários dias se não semanas (ou mais)!
Veja como montar um tethaPlate e fazer uma membrana amarrada com os Vídeos de Treinamento
Proteínas de membrana
Muitas proteínas compreendem seções lipohilicas e hidrofílicas e estas afetam a estrutura da proteína terciária . Muitas vezes, as seções lipofílicas estão associadas a uma célula, ou organela, membrana e, portanto, as proteínas são conhecidas são conhecidas como proteínas de membrana .
Uma classe especial de proteína de membrana é projetada para facilitar o transporte de catiões ou aniões através da membrana celular lipofílica, de outra forma impermeável. Tais proteínas são conhecidas como canais iónicos .
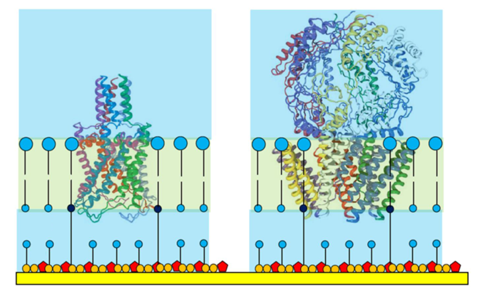
Figura 2. Proteínas de canais de íons mostradas à escala em uma membrana amarrada.
Observe a orientação da proteína para que sua "superestrutura" seja alojada
Ouside the tethaPlasm.
A relação de amarração / espaçador de uma membrana amarrada determina o tamanho máximo da proteína que pode ser alojada. A proporção padrão de 1:10 foi encontrada adequada para hospedar estruturas protéicas até 40000 Da (ou seja, essa parte da proteína realmente dentro da membrana) e essas proteínas individuais podem então se juntar em estruturas de poros oligoméricas - o que muitas vezes é a forma final da proteína Canal de íons na membrana.
Note-se que mesmo os pequenos polipéptidos do canal iônico, como a gramicidina (1882 Da) e a valinomicina (1111 Da), estão igualmente bem acomodados em membranas amarradas.
Canais iónicos maiores, como os mostrados na Figura 2, muitas vezes possuem "superestruturas" que se estendem para a solução aquosa adjacente à membrana. Mesmo uma superestrutura de tamanho moderado não pode ser acomodada dentro da tethaPlasm lotada forçando a proteína da membrana a adotar uma orienção preferida (como acontece frequentemente em uma célula viva).
Canais de íons
Os ionóforos polipeptídicos de baixo peso molecular e os canais iónicos (tais como gramicidina, valinomicina, magainina, alametina e ionomicina) estão disponíveis comercialmente na forma pura. Proteínas maiores podem estar disponíveis comercialmente em uma matriz detergente ou lipídica. No entanto, as proteínas mais grandes devem ser feitas sob medida usando cultura bacteriana, usando técnicas genômicas tanto em casa como por uma empresa de biotecnologia contratada.
Tipicamente, a bactéria da cultura possui o gene apropriado ou o fragmento de ARN inserido artificialmente nelas de modo a que existam a proteína do canal iónico desejada. Após vários dias de incubação, as bactérias são colhidas e os componentes proteicos separados e purificados (muitas vezes por eletroforese em gel).
Considerando que esta foi tecnologia de ponta na década de 1990, essas técnicas estão agora bem desenvolvidas e amplamente disponíveis em laboratórios de proteômica .
Acredita-se que o próprio genoma humano codifique cerca de 400 tipos diferentes de canais iónicos, e apenas uma fração destes já foi estudada em detalhes. No entanto, apenas um punhado de íons - potássio de sódio, cálcio, magnésio, hidrogênio, cloreto (e outros aniões) - são relevantes para o estudo dos canais iónicos. A grande variedade de canais iónicos é necessária para diferentes tipos de atividade em diferentes tecidos. Por exemplo, diferentes canais de íons de potássio podem ser envolvidos na propagação de potencial de ação em células nevadas, a regulação do ritmo cardíaco, a resposta das células às mudanças de pressão (canais iónicos sensíveis a mechano).
Os canais iônicos semelhantes ocorrem em diferentes organismos, porém a estrutura geralmente é ligeiramente alterada para otimizar a função conforme exigido pelas espécies em questão.
Ionóforos
Ambos naturais (como ionomicina e calicimicina ) e ionóforos artificiais, como éteres de coroa, calixeranos e criptas) também podem ser estudados com sistemas de membrana amarrados. Os ionóforos nem sempre são polipéptidos e podem ser moléculas bastante pequenas, no entanto, devem ser pelo menos parcialmente lipohílicos para garantir que possam entrar na membrana.
Aperto de patch clássico
O experimento clássico de grampo de patch usa um eletrodo de micropipeta que é posicionado contra uma membrana celular para cobrir apenas um ou alguns canais de íons. Geralmente, é necessário um processo prolongado de teste e erro para obter o eletrodo na posição correta. O sinal de corrente iónica é normalmente muito pequeno (alguns picoamperes) e é preciso ter muito cuidado para alcançar bons níveis de sinal / ruído.
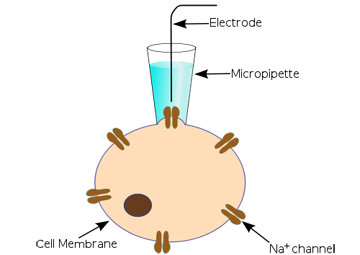
Figura 3 . Uma experiência de grampeamento clássico (http://en.wikipedia.org/wiki/Patch_clamp)
As variantes da técnica incluem o clampamento de células inteiras e de oócitos onde os sinais de muitos canais iónicos podem ser gravados simultaneamente. Isso dá um sinal maior (e mais silencioso), mas pode ser complicado por haver vários tipos de canais de íons presentes.
Nos últimos anos, os pincéis automatizados entraram no mercado, mas a técnica ainda é dificultada pela dificuldade de posicionar um eletrodo de micropipeta para obter sinais reprodutíveis.
Revolução genômica / proteômica
Como mencionado acima, os primeiros anos do século 21 viram o desenvolvimento raphid de técnicas de genômica e proteômica, de modo que agora é possível isolar quantidades de um único tipo de proteína de canal de iões. Esta tecnologia agora é generalizada em universidades, institutos de pesquisa, laboratórios de empresas farmacêuticas e departamentos de pesquisa hospitalar.
Pela primeira vez, os estudos agora podem ser feitos de forma rotineira, com quantidades razoáveis de proteína pura que dão um único tipo de canal iónico. Os pesquisadores não estão mais restritos a fazer manchas em que apenas um ou vários poros do canal iônico estão sendo monitorados.
 Ao montar um único tipo de proteína de canal de iões em um grande remendo (área de 2,1 mm 2 ) de membrana de membrana amarrada artificial, entre 1 e 10 milhões de canais podem ser estudados em paralelo. A corrente de íons medida é a soma total de todos os canais de íons no patch, de modo que os sinais nas gamas de microampere são obtidos com níveis de ruído concomitantemente baixos. Uma vez que os canais de íons se habitam espontaneamente na membrana amarrada que já está ligada ao eletrodo de trabalho, não há uma abordagem de "hit-or-miss" com um eletrodo de micropipeta.
Ao montar um único tipo de proteína de canal de iões em um grande remendo (área de 2,1 mm 2 ) de membrana de membrana amarrada artificial, entre 1 e 10 milhões de canais podem ser estudados em paralelo. A corrente de íons medida é a soma total de todos os canais de íons no patch, de modo que os sinais nas gamas de microampere são obtidos com níveis de ruído concomitantemente baixos. Uma vez que os canais de íons se habitam espontaneamente na membrana amarrada que já está ligada ao eletrodo de trabalho, não há uma abordagem de "hit-or-miss" com um eletrodo de micropipeta.
As técnicas de tethaPatch ™, embora análogas ao aperto de patch de células inteiras , normalmente fornecem resultados em minutos que, de outra forma, levariam horas com técnicas convencionais. Também porque as membranas amarradas são muito robustas, podem ser aplicados pulsos de tensão que, de outra forma, "sopro" a vedação de uma preparação de grampo tradicional. Assim, os canais de íons sensíveis à tensão e miossensíveis podem agora ser estudados em uma ampla gama de amplitudes de pulso (potenciais entre -500 a +800 mV podem ser aplicados) do que anteriormente alcançável (tipicamente inferior a ± 300 mV), levando a novos conhecimentos No mecanismo de comportamento do canal iônico.
O potenciostato integrado ER466 é adequado para uso com o tethaPatch para geração de impulsos e aquisição de dados do sinal atual.
As técnicas tethaPod aproveitam os sinais relativamente grandes fornecidos por um sistema de membrana amarrada. Ao aplicar um sinal CA de pequena amplitude (20 mV) de freqüência variável aos eletrodos de um tethaPlate ™, a condutividade e a capacitância da membrana podem ser determinadas diretamente. Isto é particularmente relevante para estudos farmacêuticos onde o monitoramento contínuo da condutância da membrana pode ser feito enquanto várias concentrações de bloqueador ou atuador de canal iónico são adicionadas ao tethaPlate ™. Os resultados podem então ser analisados por métodos de dose / resposta, permitindo o rastreio rápido de potenciais candidatos a medicamentos.
Citações
Estudo Comparativo da Função de NaChBac de Sodium Bacteriano usando Patch Clamp e Espectroscopia de Impedância AC em uma Membrana Tethered.
Bruce A. Cornell, Gwenael Scolan, Andrew M. Powl, Sonia Carne, Bonnie A. Wallace, Biophysical Journal, 102, 3, 338a, 2012. DOI: 10.1016 / j.bpj.2011.11.1852
O efeito protetor do TMAO osmoprotectante em canais mechanosensitivos bacterianos de pequena condutância MscS / MscK sob alta pressão hidrostática.
Evgeny Petrov, Paul R. Rohde, Bruce Cornell e Boris Martinac. Canais, 6: 4, 1-10, 2012. DOI: 10.4161 / chan.20833
Ion Channel Proteins que Inspecionam Espontaneamente em Membranas de Bilíme Lipídico: um Estudo de Espectroscopia de Impedância Empregando Membranas Tethered.
Bruce A. Cornell, Heba Alkhamici, Louise Brown, Sonia Carne, Sophia C. Goodchild, Russell Richards e Stella M. Valenzuela. Biophysical Journal, 102, 682a-683a, 2012. DOI: 10.1016 / j.bpj.2011.11.3710
Uma Técnica de Alto Rendimento para Triagem de Novos Agentes Antibacterianos que visam os Canais Mechanosensitivos Bacterianos.
Bruce A. Cornell, Andrew R. Battle, Sonia Carne e Boris Martinac. Biophysical Journal, 102,122a, 2012.
DOI: 10.1016 / j.bpj.2011.11.683
Fazer as membranas lipídicas ainda mais duras.
Jognandan Prashar, Phillip Sharp, Mathew Scarffe e Bruce Cornell. Journal of Materials Research, 22, 2189-2194, 2007. DOI: 10.1557 / jmr.2007.0288
Membranas Bilayer Tethered Contendo Reservatórios Iônicos: Seletividade e Conduta.
Gowri Krishna, Jurgen Schulte, Bruce A. Cornell, Ron J. Pace e Peter D. Osman. Langmuir, 19, 2294-2305, 2003.
DOI: 10.1021 / la026238d
Membranas de Bilayer Tethered Contendo Reservatórios Iônicos: A Capacidade de Interfacial.
Gowri Krishna, Jurgen Schulte, Bruce A. Cornell, Ron Pace, Lech Wieczorek e Peter D. Osman. Langmuir, 17, 4858-4866, 2001. DOI: 10.1021 / la001480a
Membranas lipídicas de bicamada amarrada como um suporte para péptidos ativos na membrana.
BA Cornell, G. Krishna, PD Osman, RD Pace e L. Wieczorek. Transações da Sociedade Bioquímica, 29, 613-617, 2001. DOI: 10.1042 / bst0290613
Membranas Bilayer Lipídicas Tethered: Formação e Caracterização do Reservatório Iónico.
Burkhard Raguse, Vijoleta Braach-Maksvytis, Bruce A. Cornell, Lionel G. King, Peter DJ Osman, Ron J. Pace e Lech Wieczorek. Langmuir, 1998, 14, 648-659 1998. DOI: 10.1021 / la9711239